La
transparencia del agua (Tabla 1) fue menor durante los muestreos de verano y se
observó una correlación positiva entre el número de células
y biovolumen de diatomeas y el disco de Secchi (r= 0.80; p= 0.017) lo que
nos podría indicar que la transparencia del agua no se ve influenciada por la
presencia de las diatomeas. En un estudio en el
embalse Paso de Las Piedras encontró una correlación positiva entre
transparencia y biovolumen donde las especies dominantes eran diatomeas
(Fernández, 2010). Con C. furcoides si bien se
observó una correlación negativa entre la abundancia y el disco de Secchi esta
no fue significativa (r=-0.28; p=0.50). Por lo que se
infiere que el tamaño de las células que conforman el fitoplancton podría
influir en la transparencia.
El pH
fue elevado (Tablas 1 y 2) el embalse y sus tributarios se caracterizaron por
presentar aguas alcalinas con un rango de variación de pH
menor que en otros trabajos realizados en la misma área de estudio (García de
Emiliani, 1977; Rodríguez et al., 2000, Daga y Pierotto, 2011). Las mayores
tasas de fotosíntesis fitoplanctónica podrían ser responsables de los altos
valores de pH observados (Rodríguez et al., 2013).
La
conductividad presentó valores mayores en la desembocadura del rio Cosquín, E2
(Tabla 2). Este tributario presenta altos contenidos
de carbonatos que provienen principalmente de la disolución de minerales
carbonáticos (calcita, dolomita, etc.) y silicatos presentes en rocas y suelos
de la subcuenca (Gaiero, 1998). En este tributario se observó la presencia de
especies que no prosperan en aguas con bajo contenido
de carbonato de calcio como la diatomea Gomphonema olivaceum var. calcarea y el alga verde Phacotus
lenticularis (Winsborough y Golubic, 1987, Schlegel
et al., 1998, Gruenert y Raeder, 2014).
Las
concentraciones de oxígeno disuelto en todas las estaciones de muestreo presentaron
un patrón de variación temporal que se explica en relación a la solubilidad de
este gas con la temperatura, aumentando considerablemente al disminuir la misma
(Tablas 1 y 2). Se observa que los valores son mayores en
otoño-invierno y más bajos en primavera-verano. Idéntica situación fue registrada en otros trabajos realizados en la
misma área (García de Emiliani, 1977, Daga y Pierotto 2011).
En el embalse y sus tributarios
se registraron 204 taxones distribuidos en nueve grupos, las Diatomea
presentaron el mayor número de especies (85), en segundo lugar las
Chloroplastida (66), continuan luego las Cyanobacteria (27), Euglenozoa (17),
Chrysophyceae (4), Cryptophyceae (2), Rhodophyceae (1), Xanthophyceae (1) y
Dinophyceae (1).
La estación de muestreo con
mayor número de especies fue E5, con un promedio de 31 especies y el
menor número de especies ocurrió en E1 y E4, con un
promedio de 8 especies. Un análisis de la varianza no paramétrica (prueba
Kruskal Wallis) para la riqueza de especies, permitió agrupar las estaciones
de muestreo E1 y E4 por un lado y E2, E3 y
E5 por el otro presentando diferencias significativas entre los dos
grupos (H= 26.91; p= 0.0001).
Dentro de los resultados
obtenidos las diatomeas presentaron la mayor riqueza de especies. Los taxones
más frecuentes para E1 fueron las diatomeas
centrales como Aulacoseira granulata con una frecuencia del 100%.
Esta especie está citada como abundante para numerosos embalses como
el de Salto Grande (De León y Chalar, 2003), el embalse de Río Hondo
(Subsecretaria de Recursos Hídricos, 2008) y Yacyretá (Meichtry de Zamburlín et
al., 2013) y para tributarios del rio Paraná
(O´Farrell & Tell, 2001; García de Emiliani & Devercelli, 2004).
Otra diatomea representativa
para E1 fue Cyclotella meneghiniana presentó una frecuencia
del 40%. Especie que tolera un alto rango de conductividad y es común en
ambientes acuáticos con abundante materia orgánica (Isra de Alcántara et al.,
2002, Ortega Murillo et al., 2010).
En la desembocadura de los
tributarios las especies que presentaron mayor frecuencia fueron Ulnaria
ulna con el 80%, Navicula gregaria con el 60% y Melosira varians
con una frecuencia del 50%. Las tres especies mencionadas junto a Gomphonema
parvulum, Fragilaria construens, Navicula cryptocephala y Nitzschia
palea son consideradas tolerantes a la polución y buenas indicadoras de
eutrofización (Sabater et al., 1988; Morales, 2016).
Las Chloroplastida presentaron una mayor riqueza de
especies en las desembocaduras de los tributarios con
un máximo desarrollo en primavera y verano, donde las condiciones
ambientales como la poca profundidad, largos períodos de luz solar y
temperaturas relativamente altas favorecieron su desarrollo (Luque
y Martínez de Fabricius, 2003).
Se identificaron numerosas especies unicelulares y
coloniales citadas para cuerpos de agua con altos niveles de eutrofia como Monoraphidium
griffithii; Pediastrum boryanum (Temponeras et al., 2000); Actinastrum
hantzschii, Monactinus simplex y Coelastrum reticulatum (González et
al., 2003; Becerra, 2009) y Nephrocytium
agardhianum, Staurastrum
leptocladum y Closterium aciculare (Canosa
y Pinilla, 1998; Pinilla, 2000).
Las algas verdes filamentosas representadas por Cladophora
glomerata, Chaetomorpha herbipolensis, Ulothrix sp.,
Chaetophora sp. y Oedogonium sp., generalmente se
desarrollan adheridas a algún tipo de sustrato y su presencia en el
plancton se debe al efecto de la deriva procedente del bento como consecuencia
de la acción de la velocidad de corriente (Biasotti et al., 2014; Galea
et al., 2014).
Las Cyanobacteria ocuparon el tercer
lugar en número de especies, la mayoría de los taxones son filamentosos, De
León y Chalar (2003) afirman que la dominancia de formas filamentosas sobre las
coloniales, indican condiciones turbulentas del sistema, situación acorde al
período de estudio.
Se identificaron 24 géneros de cianobacterias de los cuales 13 son
reportados en la literatura como productores de cianotoxinas: Dolichospermun, Gomphosphaeria, Limnothrix, Lyngbya, Merismopedia,
Microcystis, Oscillatoria, Phormidium, Planktothrix, Pseudoanabaena,
Synechocystis, Synechococcus y Woronichinia (De
León, 2002; Bonilla, 2009; Gianuzzi, 2011; Aguilera et al., 2018).
Dentro de Euglenozoa Trachelomonas
volvocina presentó la mayor frecuencia (15%), se la puede encontrar en todo
tipo de ambiente, sin embargo es más representativa en aguas mesotróficas a
eutróficas, por lo que se considera bioindicadora de altos niveles de trofía
(Pinilla, 2000; Rodríguez-Zambrano y Aranguren-Riaño, 2014).
Se identificó una especie de
Rhodophyceae, Compsopogon coeruleus su presencia en la parte baja de los
tributarios es por arrastre después de las crecidas (Carmona, 2012). En Córdoba
dicha especie ha sido citada en dos hábitats bien diferentes, en arroyos
serranos de aguas transparentes y baja conductividad y para un lago urbano con
tendencia a eutrofizarse en el verano y altos valores de conductividad (Leyes et
al., 2018).
Las Chrysophyceae fueron de
aparición esporádica a excepción de Anthophysa vegetans que estuvo
presente en todas las estaciones del año a excepción del verano. Las Cryptophyceae, flageladas adaptadas a las bajas
temperaturas y a la escasez de luz se identificaron solo en E1.
El grupo
de Dinophyceae estuvo representado por un solo taxón: Ceratium furcoides.
Para ambientes de agua dulce se reportan
6 especies de Ceratium donde las habituales son C. hirundinella y
C. furcoides (Popovsky y Pfiester, 1990). Ambas especies a partir de
la década del 90 comenzaron a expandirse por Sudamérica (Guerrero y Echenique,
1997; Boltovskoy et al., 2013; Silva et al., 2012).
En los últimos años C. furcoides desplazó a
C. hirundinella, probablemente un aumento de nutrientes y el cambio
climático fueron los principales factores que
contribuyen al establecimiento de C. furcoides (Meichtry de
Zaburlin et al., 2014; Cavalcante
et al., 2016). Almanza et al., (2016) sugieren que la
plasticidad fenotípica de C. furcoides podría favorecer la capacidad
invasora de este organismo, proporcionando una ventaja adicional para generar
floraciones, así como para establecerse y dominar en el nuevo hábitat. Ceratium
no produce toxinas pero genera numerosos impactos en el recurso
hídrico, como modificar las propiedades organolépticas del agua, dificultar y/o
encarecer los procesos de potabilización debido a la gran movilidad y tamaño, los organismos
decantados permanecen activos, nadan arrastrando parte del floc (decantador),
lo que produce un aumento en la turbiedad del agua disminuyendo la eficacia del
decantador. Pueden llegar hasta la superficie siendo arrastrado hacia los
filtros provocando el taponamiento prematuro de los mismos (Girbal et al.,
2000).
El número de células de fitoplancton
no presentó diferencias significativas al analizar las muestras tomadas en
distinta profundidad en la estación E1 (Prueba
de Kruskal-Wallis, H=4.64; p=0.098). Si se observaron
diferencias significativas para el número de células entre E1 y las
desembocaduras de los tributarios, E2, E3, E4
y E5 (H=15.54; p=0.0037) como también el biovolumen presentó diferencias significativas entre E1 y el resto
de los tributarios (H=22.1; p=0.0002). La mayor abundancia celular en E1
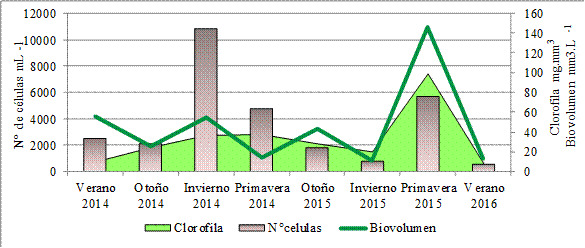
ocurrió durante el invierno de 2014 y fue de 10850 cél/mL con
un biovolumen de 55 mm3/L (Figura 2). La diatomea Aulacoserira
granulata fue dominante con 7000 cél/mL, las células restantes corresponden
a otras diatomeas y a C. furcoides.
En los muestreos restantes se observaron entre 500 a 5600 cél/mL, con
biovolumenes entre 12 y 146 mm3/L. Los mayores valores de biovolumen
se corresponden con mayores abundancias de Ceratium. Al estudiar la dinámica de las poblaciones
fitoplanctónicas se considera que es de gran importancia tener en cuenta el
número de células y el biovolumen, ya que un análisis basado sólo en el número
de células podría exagerar la importancia de las formas pequeñas, mientras que
un análisis basado sólo en el biovolumen puede aumentar la importancia de las
formas de gran tamaño (Fernández, 2010).
En la desembocadura de
los tributarios el
número de células estuvo comprendido entre 50 a 1700 cél/mL y biovolumen entre 0.07 y 12 mm3/L. A excepción del muestreo
del verano de 2016 en la
desembocadura del arroyo Los Chorrillos (E4), donde se registraron
15000 cél/mL, de C. furcoides. Esta distribución irregular puede deberse
a la acción del viento que llevó todos los organismos hacia E4,
donde el agua adquirió un color marrón rojizo y un fuerte olor a pescado. Situación
semejante fue observada en
el embalse Escaba de Tucumán donde el mayor número de Ceratium hirundinella se
registró en el río Singuil, tributario del embalse Escaba y atribuyen este
aumento a una influencia del viento (Martinez de Marco et al., 2018).
El biovolumen de los tributarios (a
excepción del valor extraordinario del verano de 2016 para E4) se
encuentra entre los valores mencionados para una revisión de unos 50 ríos del
mundo (81 % templados y 19 % tropicales) con valores promedios entre 0.06 y 25
mm3 (Rojo et al., 1994, tomado de Zalocar, 1999).
Se observaron cianobacterias productoras de toxinas de los
géneros Planktothrix y Limnotrix en las desembocaduras de los
tributarios E4 y E5 con biovolúmenes de 0.006 mm3/L y de 0.03
mm3/L. La Organización Mundial de la Salud establece Niveles
Guía de biovolúmenes para cianobacterias potencialmente productoras de toxinas
(Chorus y Bartram, 1999) donde valores entre 0.02 a 0.2 mm3/L indicarían un nivel de
vigilancia aconsejando aumentar la frecuencia de muestreos.
La clorofila a en la estación E1
presentó el mínimo valor en el verano de 2016 coincidiendo con el menor número
de células y el menor valor de biovolumen. El máximo valor de clorofila se registró en la primavera de 2015 donde
también se registró el máximo valor de biovolumen.
Los mayores valores de clorofila a
se corresponden con altas densidades de Ceratium, si bien no hay una relación lineal entre el tamaño celular y el
contenido de clorofila a, los organismos de mayor volumen celular tienen
un contenido de clorofila a mayor que los organismos pequeños y
contribuyen en mayor proporción a la productividad neta del ecosistema (Felip y
Catalán, 2000). La clorofila a presentó una
correlación positiva con el número de células (r= 0.76; p=
0.043).
Las
dimensiones de C. furcoides no fue la misma a lo largo de todo el
estudio. Al realizar las mediciones de varios organismos se pudo observar que
cuando la abundancia de C. furcoides fue mayor las células tenían menor
tamaño (Media del largo celular = 185 µm; Media del ancho = 30 µm). Por el
contrario, cuando la abundancia fue menor, el tamaño de C. furcoides se
incrementó (Media del largo celular = 190 µm; Media del ancho = 41 µm). La
diversidad se calculó a través del índice de Shannon & Weaver y presentó
valores bajos (< a 1) en el embalse propiamente dicho (E1) debido
a la desproporcionada representación numérica de una especie dominante y
subdominancia de otras pocas especies, así como una reducida abundancia para la
mayoría de los taxones. Resultados semejantes fueron
observados para el San Roque hace poco más de una década (Prósperi et al., 2007), mientras que en un estudio
realizado hace más de cuarenta años para el mismo embalse la diversidad
oscilaba entre 1.5 y 3 bits (García de
Emiliani, 1977). Una reducción de la diversidad es un excelente indicador de
contaminación (Patrick et al., 1949) ya que la polución rompe un equilibrio
preexistente y la comunidad se simplifica. Disminuye la riqueza de especies,
pero algunas de ellas pueden estar representadas por un número elevado de
individuos. En tal sentido, Sournia (1978) señaló que la diversidad disminuye
cuando los individuos de especies raras son sustituidos por individuos de
especies que ya eran comunes.
El
análisis del estado trófico se efectuó a través del TSI (Trophic Status Index),
el cual tiene en cuenta la concentración de clorofila a, la
concentración de fósforo total y la transparencia del agua medida con el disco
de Secchi. Los valores del TSI para el disco de Secchi
oscilaron entre 59 a 68, para el fósforo, estuvieron comprendidos entre 69 a
115 y para la clorofila entre 48 a 75 (Tabla 3).
Tabla 3.
Variación del estado trófico del embalse San Roque.
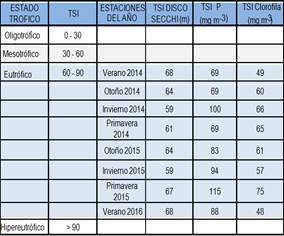
De acuerdo a los valores del disco
de Secchi en el 75% de los muestreos clasificamos al embalse
como eutrófico y el 25% restante como mesotrófico. De acuerdo al fósforo en el
62 % de los muestreos el embalse se encuentra eutrófico con tendencia a
hipertrófico. Teniendo en cuenta la clorofila en el 50% de los muestreos el
embalse se encuentra en estado mesotrófico y el 50% restante eutrófico.
Altos valores del índice de estado trófico
calculados a partir de la concentración de fósforo total en relación a las
otras variables también apoyarían el hecho que el fitoplancton probablemente
esté limitado por otros factores más que por la concentración de fósforo
(Fernández, 2010). Carlson (1977) sugiere que, para los fines de clasificación
del estado trófico, se le dé prioridad a parámetros biológicos tales como la
clorofila.
En coincidencia con Fernández-Cirelli (1999) la
eutrofización debe analizarse desde el punto de vista de sus causas y de sus consecuencias, ya que termina siendo un
problema para la salud de la población.
CONCLUSIONES
Se determinaron un total de 204 Taxa donde el
componente dominante fue el dinoflagelado Ceratium furcoides y como
subdominante la diatomea Aulacoseira granulata.
La elevada biomasa fitoplanctonica la baja
diversidad, los cambios de coloración y el estado de eutrofia son características
que indican un significativo deterioro de la calidad del recurso
hídrico.
Dado que el uso principal es la provisión de agua para consumo se
considera que es importante planificar actividades concretas de control de
eutrofización y para ello se hará necesario diseñar un plan de manejo adecuado.
Aguilera, A., Haakonssonb, S., Martina, M. V., Salerno, G.
L. y Echenique, R. (2018). Bloom-forming cyanobacteria and cyanotoxins in
Argentina: A growing health and environmental concern. Limnologica, 69:103-114.
Almanza, V., Bicudo, C. M., Parra, O. y Urrutia, R. (2016).
Características morfológicas y limnológicas de las floraciones de Ceratium
furcoides (Dinophyta) en un lago somero de Chile Central. Limnetica, 35 (1):
253-268.
Amé, V., Ferral, A. y Solís, V. (2017). Eutrofización en el
embalse San Roque y floraciones masivas de cianobacterias. Seguimiento por
técnicas geoespaciales. UNCiencia. http://unciencia.unc.edu.ar/2017.
APHA. (1992). Standard Methods for the Examination of
Waters and Wastewaters, 19th edn. APHA/AWWA/WPCF, Washington, DC. P. 1193.
Becerra, C. L. E. (2009). Catálogo fitoplanctónico de los
lagos del Dique, municipio de Xalapa, Veracruz, México (Tesis de licenciatura).
Universidad Veracruzana: Veracruz, México.
Biasotti, A. E, Álvarez, S. B., Bazán, G. I. y Martínez de
Fabricius, A. L. (2014). Variación estacional de la comunidad
microfitoplanctónica del curso medio del Río Colorado (La Pampa-Argentina).
Biología Acuática, 30: 249-258.
Boltovskoy, A., Echenique, R. y Guerrero, J. M. (2013).
Colonización de limnotopos de Argentina por Ceratium hirundinella
(Dinophyceae). Memorias XXIX Jornadas Argentinas de Botánica y XV Reunión Anual
de la Sociedad Botánica de Chile. Boletín de la Sociedad Argentina de Botánica,
38 (Supl.).
Bonilla, S. (2009). Cianobacterias planctónicas del
Uruguay. Manual para la identificación y medidas de gestión (No. 582.232 UNE).
UNESCO. Administración de las Obras Sanitarias del Estado (Uruguay).
Montevideo. Universidad de la República.
Cachi, J. (1975). Variaciones Planctónicas del Embalse San
Roque y su relación con los procesos de potabilización. O.S.N., 26 pp.
Canosa, A. y Pinilla, G. (1998). Evaluación de la población
bacteriana total en tres cuerpos de agua lénticos mediante la técnica de
epifluorecencia. Informe final de proyecto. Colciencias, Universidad Jorge
Tadeo Lozano. Bogotá. 60 pp.
Carlson, R. E. (1977). A trophic state index for lakes.
Limnology Oceanography, 22: 361-369.
Carmona Jiménez, J. (2012). Las algas rojas (Rhodophyta) de
agua dulce en la región central de México. Taxonomía y distribución.
Monografías ficológicas V. 4.
Cavalcante, K. P., Cardoso, L. S., Sussella, R. y Becker,
V. (2016). Towards a comprehension of Ceratium (Dinophyceae) invasion in
Brazilian freshwaters: autecology of C. furcoides in subtropical reservoirs.
Hydrobiologia, 771(1):265-280.
Chorus, I. y Bartram, J. (1999). Toxic cyanobacteria
in water: a guide to their public health consequences, monitoring and
management / edited by Ingrid Chorus and JamieBertram. WorldHealth
Organization.https://apps.who.int/iris/handle/10665/42827
Daga, C. y Pierotto, M. (2011). Cianobacterias de la cuenca
del Embalse San Roque. Boletín Sociedad Argentina de Botánica, 46 (3-4):
227-234.
Degano M., Rodríguez, M. I. y Dasso C. (2016). Dinámica
térmica de cuerpos de agua eutróficos: caso Embalse San Roque. Revista Facultad
de Ciencias Exactas, Físicas y Naturales. V 3(1): 93-100.
De León, L. (2002). Floraciones de cianobacterias en aguas
continentales del Uruguay: causas y consecuencias. En: Domínguez, A. &
Prieto, R. G. (eds.). Perfil ambiental del Uruguay 2002. Nordan Comunidad,
Montevideo: 28-37.
De León, L. y Chalar, G. (2003). Abundancia y diversidad
del fitoplancton en el embalse de Salto Grande (Argentina – Uruguay). Ciclo
estacional y distribución espacial. Limnetica, 22 (1-2): 103-113.
Di Rienzo, J. A., Casanoves, F., Balzarini, M. G.,
González, L., Tablada, M. y Robledo, C. W. (2017). Grupo InfoStat, FCA,
Universidad Nacional de Córdoba, Argentina. URL http://www. infostat.com.ar.
Felip, M. y Catalan, J. (2000). The Relationship Between
Phytoplankton Biovolume and Chlorophyll in a Deep Oligotrophic Lake: Decoupling
in Their Spatial and Temporal Maxima. Journal of Plankton Research,
22(1):91-105.
Fernández Cirelli, A. (1999). Aprovechamiento y Gestión de
Recursos Hídricos. Programa Iberoamericano de Ciencia y Tecnología para el
Desarrollo.
Fernández, C. (2010). Caracterización limnológica de un
ambiente eutrófico: el embalse Paso de las Piedras, Argentina. Bioecología del
fitoplancton. (Tesis de Doctorado en Biología). Universidad Nacional del Sur.
Bahía Blanca.
Gaiero, D. (1998). Hidrogeoquímica de un sistema de la
región semiárida: el Río Suquía, Córdoba, 2. Transporte de sólidos disueltos,
meteorización y consumo de CO2. Revista de la Asociación Geológica Argentina, 53(3):
337:347.
Galea, M. J., Bazán, G. I., Álvarez, S. B. y Martínez De
Fabricius, A. L. (2014). Estudio del fitoplancton aguas arriba y aguas abajo
del Dique Embalse Casa de Piedra, río Colorado (La Pampa, Argentina). Biología
Acuática, 30: 287-300.
Garcia de Emiliani, M. O. (1977). Ciclo Anual del
Fitoplancton en el Embalse San Roque (Córdoba, Argentina). Revista de la
Asociación de Ciencias Naturales del Litoral, 8:1-12.
Garcia de Emiliani, M. O. y Devercelli, M. (2004).
Estructura y dinámica del fitoplancton de un rio tributario (Salado) y cauces
secundarios del rio Paraná (Santa Fé, Coronda y El Vado) en el área de
confluencia (Santa Fé, Argentina). Revista FABICIB, 8: 23-42.
Gavilán, J. G. (1981). Study of Water Quality in the San
Roque Reservoir. Water Quality Boulletin, Environment Canadá, 6(4): 136-158.
Gianuzzi, L. (2011). Cianobacterias como Determinantes
Ambientales en la Salud, 1a ed., Buenos Aires, Ministerio de Salud de la Nación.
Girbal, A., Lammel, E. y Busso, F. (2000). Utilización de
permanganato de potasio para mitigar un bloom de Ceratium hirundinella.
Resúmenes del Seminario Internacional: Identificación y Control de Algas en la
Producción de Agua Potable.
González, E. J., Ortaz, M., Peñaherrera, C., Montes, E.,
Matos, M. L. y Mendoza, J. (2003). Fitoplancton de cinco embalses de Venezuela
con diferentes estados tróficos. Limnetica, 22 (1-2): 15-35.
Gruenert, U. y Raeder, U. (2014). Growth responses of the
calcite-loricated freshwater phytoflagellate Phacotus lenticularis
(Chlorophyta) to the CaCO3 saturation state and meteorological changes. Journal
of Plankton Research, 36(3): 630-640.
Guarrera, S. (1948). El fitoplancton del embalse San Roque.
Revista del Museo. Argentino de Ciencias. Naturales “Bernardino Rivadavia”, 1
(2): 29-55.
Guerrero, J. M. y Echenique, R. O. (1997). Ceratium
hirundinella blooms in Argentine reservoirs. Harmful Algae News 16: 3.
Hillebrand, H., Durselen, C. D., Kirschtel, U., Pollingher,
T. y Zohary, T. (1999). Biovolume calculation for pelagic and benthic microalgae.
Journal of Phycology, 35: 403-424.
Isra de Alcántara, I., Garduño-Monroy, V. H. y
Ortega–Murillo, R. (2002). Paleoambiente lacustre del Cuaternario tardío en el
centro del lago de Cuitzeo. Hidrobiologica, 2: 61–78.
Leyes, C., Bustamante, A., Giovanola, C. y Daga, C. (2018).
Primer registro de Compsopogon caeruleus (Rhodophyta, Compsopogonales) en
Córdoba (Argentina). Lilloa, 55(2): 67-74.
Luque, M. E. y Martínez de Fabricius, A. L. (2003).
Distribución temporal del fitoplancton y epiliton en el río Piedra Blanca
(Córdoba, Argentina). Limnetica, 22(3-4): 19-34.
Martínez de Marco, S. N., Tracanna, B. C., Isasmendi, S.
C., Alderete, M del C., Taboada, M. de los A. y Mirande, V. (2018). Evaluación
del fitoplancton en el embalse Escaba (Tucumán – Argentina) para caracterizar
la calidad de sus aguas. Boletín de la Sociedad Argentina de Botánica, 53 (4):
521-542.
Meichtry de Zaburlin, N., Vogler, R. E., Llano, V. M. y
Martens, I. S. M. (2013). Fitoplancton del embalse Yacyretá (Argentina
Paraguay) a una década de su llenado. Revista Mexicana de Biodiversidad, 84(1):
225-239
Meichtry de Zaburlin, N., Boltovskoy, A., Costigliolo
Rojas, C. y Rodríguez, R. (2014). Primer registro del dinoflagelado invasor
Ceratium furcoides (Levander) -Langhans 1925 en la Argentina y su distribución
en el área de influencia del Embalse Yacyretá (río Paraná, Argentina-Paraguay).
Limnetica, 33 (1): 153-160.
Morales, E. A. (2016). Floración de Ceratium furcoides
(Levander) Langhans (Dinoflagellata, Dinophyceae) en la represa de La Angostura,
Cochabamba, Bolivia. Acta Nova, 7(4):389-398.
O´Farrell, I. y Tell, G. (2001). Morphological variability
of Aulacoseira granulata (Ehr.) Simonsen (Bacillariophyceae) in the Lower
Paraná River (Argentina). Limnology, 2(2):65-71.
Ortega-Murillo, M. R., Alvarado-Villanueva, R., Hernández
Morales, R. y Sánchez-Heredia, J. D. (2010). Evolución trófica de un lago
tropical hiposalino en México con base al fitoplancton. Revista Biológicas, 12:
75-81.
Pasquini A. I., Lecomte, K. L., Piovano E. y Depetris P. J.
(2006). Recent rainfall and runoff variability in central Argentina. Quaternary
International, 158: 127-139.
Patrick, R. (1949). A proposed biological measure of stream
conditions, based on a survey of the Conestoga Basin, Lancaster Country,
Pennsylvania. Proc. Acad. Nat. Sc. Philadelphia. 101: 227- 341.
Pinilla, G. A. (2000). Indicadores biológicos en
ecosistemas acuáticos continentales de Colombia. Bogotá. Fundación Universidad
de Bogotá Jorge Tadeo Lozano.
Piovano, E., Ariztegui, D., Córdoba, F., Cioccale, M. y
Sylvestre, F. (2009). Hydrological variability in South America below the
Tropic of Capricorn (Pampas and eastern Patagonia, Argentina) during the last
13.0 ka. En: Vimeux. F., Sylvestre, F., Khodri, M. (Eds.) Past climate
variability from the Last Glacial Maximum to the Holocene in South America and
Surrounding regions: From the Last Glacial Maximum to the Holocene). Springer -
Developments in Paleoenvironmental Research Series (DPER), 323–351.
Pizzolón, L.,Tracanna, B., Prósperi, C. y Guerrero, J.
(1999). Cianobacterial blooms in argentinean inland water. Lakes and
Reservoirs: Research & Management, 4: 101-105.
Popovsky, J. y Pfiester, L. A. (1990). Dinophyceae (Dinoflagellida).
In: Ettl, H., Gerloff, J., Heynig, H. and Mollenhauer, D., Süsswassserflora von
Mitteleropa. Begründet von A. Pascher. Band 6. Jena, Gustav Fischer Verlag.
Prósperi, C., Pierotto, M., Daga, C. y Rincón, A.
(2007). Monitoreo de cianobacterias toxicas en embalses de Córdoba (Programa
Conapris). Memorias V Taller Internacional sobre enfoques regionales para el
desarrollo y gestión de embalses en la cuenca del Plata. Itaipú .Brasil-
Paraguay.
Reyna, S., Orso, M., Reyna, E., Lábaque, M. y Gómez, C.
(2005). Plan de gestión de los recursos hídricos de la provincia de Córdoba.
Subsecretaria de Recursos Hídricos.
Rodríguez, M. I., Cossavella, A., Oroná, C., Larrossa, N.,
Avena, M., Rodriguez, A., Del Olmo, S., Bertucci, C., Muñoz, A., Castelló, E.,
Bazán, R. y Martínez, M. (2000). Estudios preliminares de la calidad de agua y
sedimentos del embalse San Roque relacionados al proceso de eutroficación.
Memorias XVIII Congreso Nacional Del Agua, Santiago Del Estero, Argentina.
Rodríguez, M. I., Busso, F., Bustamante, M. A., Ruibal
Conti, A. L., Ruiz, M. y Angelaccio, C. M. (2005). Floraciones de algas en el
embalse San Roque (Córdoba). Memorias XX Congreso Nacional del Agua y III
Simposio de Recursos Hídricos del Cono Sur. Mendoza.
Rodríguez, M. I., Ruiz, M., Nadal, N., Halac, S., Olivera,
P., Busso, F. y Bonfanti, E. (2013). Monitoreo y calidad de agua del embalse
San Roque (Cba., Argentina). Memorias XXIV Congreso Nacional del Agua
(CONAGUA). San Juan. Argentina.
Rodríguez-Zambrano, A. P. y Aranguren-Riaño, N. J. (2014).
Comunidad planctónica de un embalse con alta tensión ambiental: La Playa,
cuenca alta del río Chicamocha (Tuta, Boyacá), Colombia. Biota Colombiana, 15
(2): 95-110.
Ruibal Conti, A. L., Bustamante, A., Granero, M., López,
F., Girbal, A., Lammel, E., Simonin, M. y Busso, F. (1999). Estudio de la
evolución de la calidad de agua del embalse San Roque (Córdoba) asociado al
desarrollo de floraciones de Ceratium. Memorias Congreso Argentino de Gran
Presas y Aprovechamiento Hidroeléctricos. San Martín de Los Andes. Argentina.
Sabater, S., Sabater, F. y Armengol, J. (1988).
Relationships between diatom assemblages and physico-chemical variables in the
River Ter (N.E. Spain). Internationale Revue gesamten Hydrobiologie, 73:
171-179.
Schlegel, I., Koschel, R. y Krienitz, L. (1998). On the
occurrence of Phacotus lenticularis (Chlorophyta) in lakes of different trophic
state. Hydrobiologia, 69: 353- 361.
Shannon, C. E. y Weaver, W. (1949). The Mathematical Theory
of Communication. Urbana. Chicago, III. Univ. Illinois Press, London.
Silva, L. C., Leone, I. C., Santos-Wisniewski, M. J.,
Peret, A. C. y Rocha, O. (2012). Invasion of the dinoflagellate Ceratium
furcoides (Levander) Langhans 1925 at tropical reservoir and its relation to
environmental variables. Biota Neotropica, 12(2): 93–100.
Sournia, A. E. (1978). Phytoplankton manual. Monographs on
Oceanographic Methodology. 6. UNESCO. Paris.
Stumm, W. y Morgan, J.J. (1981). Aquatic Chemistry: An
Introduction Emphasizing Chemical Equilibria in Natural Waters.
Wiley-Interscience, New York.
Subsecretaria de Recursos Hídricos. (2008). Plan Nacional
Federal de los Recursos Hídricos. Coordinado por Andrés Rodríguez 1º ed. Buenos
Aires. Ministerio de Planificación Federal.
Sun, J. y Liu, D. (2003). Geometric models for calculating
cell biovolume and surface area for phytoplankton. Journal of Plankton
Research, V 25: 1331-1346.
Temponeras, M., Kristiansen, J. y Moustaka-Gouni, M.
(2000). Seasonal variation in phytoplankton composition and physicalchemical
features of the shallow Lake Doirani, Macedonia, Greece. Hydrobiologia, 424:
109-122.
Winsborough, B. y Golubić, S. (1987). The role of diatoms
in stromatolite growth: two examples from modern freshwater settings. Journal
of Phycology. 23: 195- 201.
Zalocar de Domitrovic, Y. (1999). Etructura y dinámica del
fitoplancton en la cuenca del eje potámico Paraguay-Paraná (Argentina). Tesis
doctoral, Universidad Nacional de Córdoba.
REGISTRO BIBLIOGRÁFICO
Daga, I. C., Fernández Belmonte, M. C.
y Reyna, S. M. (2020). Composición algal y bioindicadores de calidad de agua.
Caso de estudio: Embalse San Roque, Córdoba. Argentina. Cuadernos del
CURIHAM. 26: 1-11. doi: 10.35305/curiham.v26i0.143
Tipo de Publicación: ARTICULO.
Trabajo recibido el 05/06/2020
y aprobado para su publicación el 27/07/2020.
![]() (1)
(1)